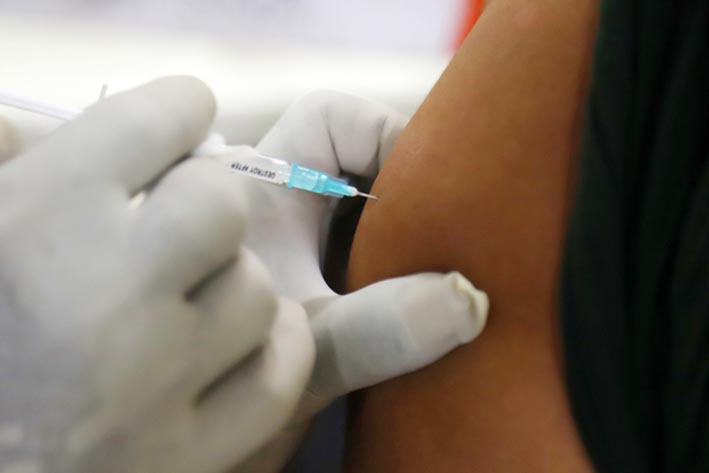
JAKARTA | patrolipost.com – Meski belum ada izin uji klinis tahap II dari Badan Pengawas Obat dan Makanan (BPOM), namun para anggota DPR dan juga beberapa tokoh nekat untuk disuntik vaksin Nusantara.
Menanggapi hal tersebut, Ketua Umum Pengurus Besar Ikatan Dokter Indonesia (PB IDI), Daeng M Faqih mengatakan BPOM sudah melakukan tugasnya secara profesional. BPOM bekerja sebagai pengawas mengatur protokol dalam sebuah penelitian obat hingga vaksin.
“Kita tahu protokol itu yang melakukan penilaian itu hanya badan POM di Indonesia. Jadi kalau bukan Badan POM yang melakukan pengawasan penilaian siapa lagi gitu,” ujar Daeng dalam diskusi secara virtual di Jakarta, Sabtu (17/4).
Oleh sebab itu, Daeng berpesan kepada para anggota dewan jangan mengambil alih peran dan fungsi dari BPOM terkait vaksin Covid-19 ini.
“DPR kerja kan dalam rangka pengawasan kelembagaan memang kerjanya mengawasi pemerintahan dan lembaga-lembaga di dalamnya. Tetapi seharusnya yang diawasi adalah kinerjanya jangan sampai kemudian seolah-olah mengambilalih kinerjanya,” katanya.
Daeng mengatakan dengan kejadian ini, dirinya menakutkan di kemudian hari BPOM akan mudah diintervensi. Sehingga kerja-kerja BPOM ini harus dijaga oleh masyarakat.
“Kalau itu tidak dijaga saya khawatir lembaga profesional ke depan seperti BPOM ini akan rentan dimasuki unsur-unsur politis. Saya sangat khawatir. Pekerjaan profesional ini harus di jaga karena prosedur keilmuan yang dikerjakan,” ungkapnya.
Diketahui, langkah anggota dewan berbondong-bondong menerima penyuntikan vaksin Nusantara ini bertentangan dengan sikap BPOM. Hingga saat ini, BPOM belum mengizinkan tim Vaksin Nusantara melanjutkan riset uji klinis ke tahap II.
Alasannya menurut Kepala BPOM Penny Lukito, tim belum melaporkan tindakan korektif yang telah diminta atas apa yang sudah dikerjakan di uji klinis tahap satu. Vaksin Nusantara yang dikembangkan dari sel dendritik yang biasa digunakan dalam terapi kanker, Penny menerangkan, masih harus memenuhi beberapa syarat.
Di antaranya, Cara Uji Klinik yang Baik (Good Clinical Practical), Proof of Concept, Good Laboratory Practice dan Cara Pembuatan Obat yang Baik (Good Manufacturing Practice).
Terawan dan kawan-kawan kata Penny, telah mengabaikan banyak aspek dalam pelaksanaan uji klinis fase I. Di antaranya, proof of yang belum terpenuhi dan antigen yang digunakan pada vaksin tersebut tidak memenuhi pharmaceutical grade.
Hasil dari uji klinis fase I terkait keamanan, efektivitas atau kemampuan potensi imunogenitas untuk meningkatkan antibodi juga dinilai belum meyakinkan. (305/jpc)